

RNA樣本準備指南
1、樣本RNA得率以及各類項目最低起始量
?
各樣本Total RNA得率統計(僅供參考):
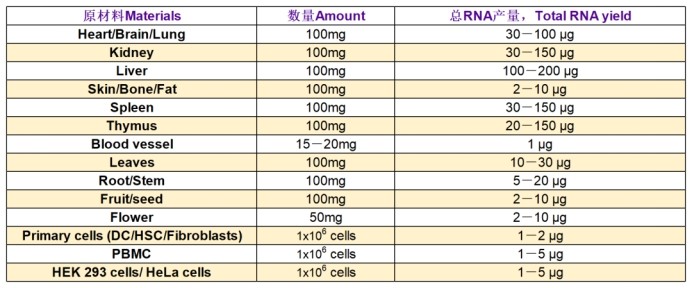
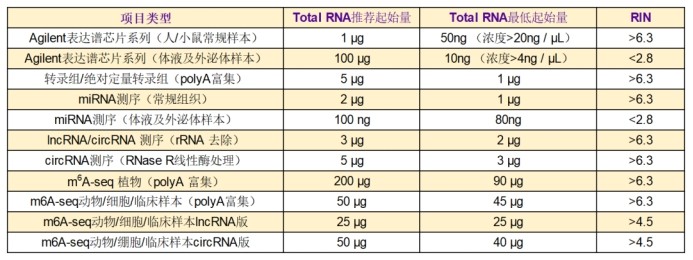
測序項目推薦起始量(起始量僅供參考,外泌體不允許18s/28s rRNA有峰):
表達譜芯片及小RNA測序體液樣本及外泌體項目起始量(僅供參考)
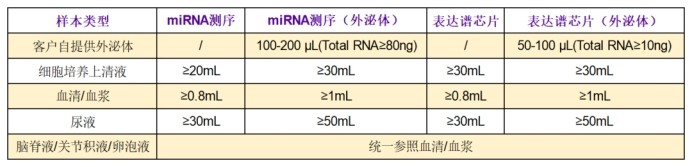
?
2、各類樣本準備指南
2.1 動物組織/臨床組織采集
① 取新鮮組織,組織體積要小,盡量長寬高≤0.5cm,考慮到可操作性,所切組織塊的大小可參考綠豆顆粒的大小
② 去除非研究的組織類型(如結締組織,脂肪組織等),如果是臨床病變組織的取材要正確判斷病變以及正常組織,應將病變組織周圍的正常組織去掉,反之亦然。
③ 迅速用2-6℃預冷RNase-Free水配制的1×PBS或生理鹽水清洗組織表面的血跡和污漬,使用無塵紙巾吸干表面的液體
④ 處理好的組織迅速放入預冷好的已寫好編號的RNase-Free的帶螺紋口的耐-192℃超低溫凍存管中,迅速置于?液氮速凍1小時后轉存于-80℃長期保存,在RNA提取前避免反復凍融。
注意事項:
a. 如果實驗室沒有條件,如缺乏液氮、干冰以及-80℃冰箱等條件下,需要RNAlater及類似組織保存液保存的樣本,嚴格按照操作說明進行,迅速的將樣本分割成長寬高≤0.5cm,約豌豆大小的小塊(一般重約100mg,不過無需精準測量,一般需要10個小塊左右),由于組織塊過大會影響RNAlater滲透入組織內部的效率,組織塊過大也會造成RNAlater無法完全覆蓋組織,而未被RNAlater覆蓋的組織部位極易被核酸酶降解。然后投入提前準備好的裝滿RNAlater的1.5mL的EP管中,使樣本完全浸沒在液體中,然后置于4℃中保存過夜,干冰運輸,或-80℃保存。
b. 不允許寄送用裂解液保存的組織樣本,因為實驗中發現用Trizol保存的組織樣本,無論是研磨好的粉末還是切割好的組織塊,所抽提的RNA質量普遍很差;
c. 動物及臨床組織不要使用錫箔紙包裹,錫箔紙容易與動物及臨床組織粘一起,RNA抽提的過程錫箔紙容易帶入,引起污染。
2.2 細胞樣品的采集

貼壁細胞的處理:
① 從培養箱取出貼壁生長細胞,顯微鏡下觀察細胞確定生長狀態良好棄培養基
② 小心加入與培養基等體積的無酶水配制的1×PBS后,平放1min洗滌細胞,然后棄去PBS,重復一次
③ 加入適量裂解液反復吹打至充分裂解(以TriZol為例,10-15cm的大皿,每次先添加1-2mL,吹打混勻,裂解充分的標準為吹打時液體不粘稠,流動性好。如果液體過于粘稠說明還未裂解充分,需添加裂解液,每次添加的量建議為100μL左右持續添加,直到液體不粘稠為止)
④轉移至?耐-192℃低溫的螺紋口凍存管后,-80℃冰箱長期保存,干冰運輸
懸浮細胞的處理:
①選取生長狀態良好的細胞懸液
②200-1000g離心5-10min,得到細胞沉淀棄培養基
③加入適量 RNase-Free水配制的1×PBS后,寬口槍頭輕柔吹打重懸細胞沉淀,然后用200g離心5min,棄PBS, 重復一次
④加入適量TriZol裂解液反復吹打至充分裂解(裂解標準同上面的貼壁細胞處理方式類似)
④轉移至?耐-192℃低溫的螺紋口凍存管后,-80℃長期保存,干冰運輸
注意事項:
a. 勿將干凍的細胞直接寄送,因為細胞冷凍的過程中冰晶很容易刺破細胞,此時破碎的細胞會容易對RNA和RNA降解
b. 細胞樣品勿用胰酶消化,胰酶會消化細胞膜上的膜蛋白,導致細胞破裂,破裂的細胞會釋放核酸酶。
2.3 植物組織組織采集
①選取新鮮、幼嫩、生長旺盛的組織部位,植物組織越幼嫩越新鮮所含的次生代謝產物越少,隨著植物的逐漸成熟,所含的次生代謝產物產量越來越多,而次生代謝產物會影響RNA的抽提。以草莓的花為例,這么個體量的花,4朵即可,其它花朵樣本一次類推。
②(部分樣本可選項)迅速用預冷的RNase-Free水配制的1×PBS或生理鹽水清洗組織表面的污漬,吸干表面的液體。用剪刀剪切成合適的大小(若非特殊情況,長度最好不要超過2cm)
③處理好的組織迅速放入預冷好的已寫好編號的RNase-Free的?耐-192℃低溫的螺紋凍存管中,或用標記好名稱的錫箔紙包裹好,?液氮速凍>1小時,轉移到-80℃長期保存,在RNA提取前避免反復凍融,干冰寄送樣本。若在離體后10min未用液氮速凍降溫,極有可能引起樣本降解。不可直接將樣本放入-80℃保存,此時低活性的RNase仍能引起樣本降解
注意事項:
a. 植物組織不建議RNAlater保存,因為植物組織含有細胞壁及次生壁,RNAlater不易滲透入組織內部;特別是表面有蠟質的植物種植,勿用TriZol直接浸泡植物組織
b. 不允許將植物組織磨成粉寄送。
c. 表面含有較多蠟質的植物樣本或次生代謝產物含量極高的植物組織或植物組織的莖和根及種子RNA得率通常會較低,為提高RNA的得率需要加大送樣量,為普通樣本送樣量的3-4倍。
2.4 全血/PBMC/血清/血漿以及其他體液樣本搜集

聯川生物推薦使用BD公司的PAXgene?采血管采集全血,使用BD公司的真空采血管采集全血后分離血清,或使用EDTA紫色抗凝管搜集全血樣本以及分離后續的血漿樣本。不允許使用綠色的肝素采血管采集全血,因為肝素會影響PCR酶的逆轉錄效率。
a. PAXgene采血管采集全血方式:
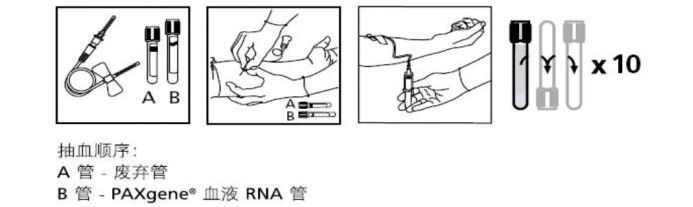
①采血前,應將采血管恢復室溫,推薦溫度為18-25℃(一般PAXgene采血管保存于室溫或4℃,最高不超過40℃)
②采血時,假如前面已經使用了多種采血管采集血液時,應該在最后使用PAXgene采血管;僅用PAXgene采血管時,先用另一個采血管采集1-2mL血樣,丟棄該采血管,再使用PAXgene采血管。這種作用是因為,采血器容積能被預灌注,另減少血壓造成的沖擊力,一定程度上清洗采血管,采血量:2.5ml,適用對象:人和靈長類動物。
③采血后,立即上下顛倒混勻十次左右,18-25℃正立放置2h。④ 若不立即提取,將采血管正立置于塑料試管架上(注意:試管架與采血管之間需留有空隙,防止低溫保存過程中管壁開裂),先于-20℃放置24h,然后轉移至-80℃進行長期保存或轉移至干冰中進行運輸。注意,在這一步中需要把采血管中的全血樣本轉到螺紋口凍存管即可放入-80℃冰箱,無需再將凍存管在?液氮速凍1小時。
⑤運輸時請使用厚壁泡沫盒,放入充足的干冰,在樣品保存及運輸過程中應避免反復凍融。
b. EDTA采血管/真空采血管采集全血方式:
①樣本采集前,先用75%的酒精棉由內向四周對采血部位進行消毒
②采血至特定的采血管中,數量達到負壓允許的最大值
③樣本采集完成后,立即輕柔顛倒混勻10次。動作盡可能平緩。加入三倍以上體積的TriZol(TriZol:血液≥3:1)裂解液混勻,此時出現沉淀為正常情況。
④混勻完畢后,立刻轉入?耐-192℃低溫的螺紋口凍存管,轉入-80℃冰箱保存,干冰運輸。注意采血至提取RNA最長時間不得超過一周。
c. 血漿中PBMC提取法:
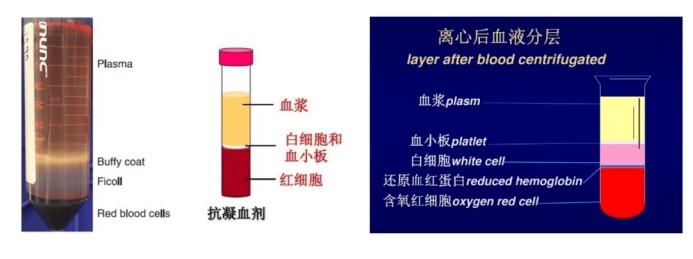
①接著上一步EDTA抗凝管離心后分層那一步,將Ficoll和PBS從低溫恢復到室溫
②向50mL離心管(標記A)中加入10mL Ficoll,隨后最好靜置一段時間;向另一只50mL離心管(標記B)加入10mL PBS
③稀釋:溫和搖勻抗凝采血管,用 kimwipes或者消毒紗布移除上蓋并放一邊,將 10mL血液轉移至B離心管,溫和混合,獲得PBS混合液(20mL)
④適度傾斜離心管A,將20mL PBS 混合液沿壁緩慢加入(注意要緩慢,過快會穿破Ficoll層,極大影響提取效果)
⑤梯度離心:小心地將離心管放入離心機(不要擾動液體層),室溫400g 20min離心,加速/減速分別設置為1/0
⑥離心之后小心將其取出,放置于操作臺上,可見分為四層,見上圖
⑦可選:先移除淋巴細胞層上2-3mm的血漿,方便后面吸取
⑧用P1000移液槍盡可能吸取PBMC,轉移至15mL離心管,盡量避免吸取血漿和Ficoll
⑨加入PBS 使體積變為10mL,蓋上蓋并溫和翻轉搖勻5次
⑩室溫 300g 10min離心,加速/減速分別設置為9/9。去上清并輕彈離心管末端,直至細胞團在剩余PBS中完全重懸
注意事項:重復步驟⑨-⑩,最后按照TriZol和體積約3:1的比例加入TriZol保證充分裂解,裂解標準請參考上面貼壁細胞裂解液處理方式
d. 血清樣本(外泌體適用)
①建議使用進口醫用血清管或真空采血管等收集全血
②上下輕輕顛倒混勻十次后,立即將全血置于4°C或冰盒中正立放置
③1800g 10min離心分離得到上層血清樣本(全血需在1h內進行血清分離,依據血清管操作說明或客戶實驗室血清分離步驟進行操作)
④將血清轉移至1.5mL離心管中,13000g離心2min;
⑤將上清轉移至規格在200μL-1.5mL耐-192℃超低溫螺紋口凍存管中,每份樣本至少≥100μL(0.1mL)。?液氮速凍1h后-80℃保存,干冰運輸
e. 血漿樣本(外泌體適用)
①建議使用紫色EDTA抗凝管收集全血樣本
②上下輕輕顛倒混勻十次后,立即將全血置于4°C或冰盒中正立放置
③1200g 10min離心分離得到上層血漿樣本(全血需在1h內進行血漿分離,依據抗凝管操作說明或客戶實驗室血漿分離步驟進行操作)
④將血漿轉移至1.5mL離心管中,13000 g離心2min
⑤將上清轉移至規格在200μL-1.5mL耐-192℃超低溫螺紋口凍存管中,每份樣本至少≥100μL(0.1mL)。?液氮速凍1h后-80℃保存,干冰運輸
注意事項:
a.分離血清血漿應嚴格按照操作說明進行,操作需在1h內完成,避免出現溶血現象,血清血漿分離后避免反復凍融。
b. 血清血漿送樣量的原則:越多越好,如果客戶手頭上的血清血漿量較少,則有多少就送多少,通常該種類型的樣本RNA含量較低,所以需要通過加大樣本量以富集足夠多的RNA,以保證后續實驗的順利進行,此外血清血漿RNA通常不質檢
c.分離血清/血漿樣本的全血不可冷凍,混入的血細胞的樣本盡量棄盡,已無法使用
d血清/血漿的RNA得率為2-8ng/mL
小貼士——
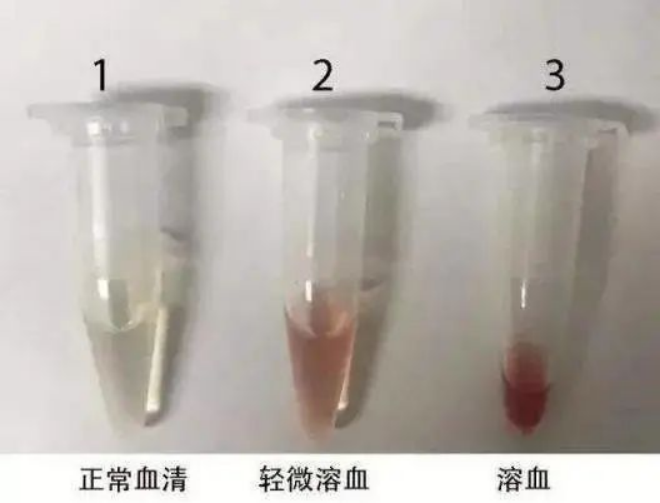
溶血現象解釋:即因紅細胞細胞膜的破裂而導致的紅細胞破碎、血紅蛋白溢出的現象。溶血可由多種物理或化學因素引起,尤其在人體外,滲透壓的變化、機械外力,溫度的變化,酸堿度的變化或血液處理的過程中人為添加的一些化學物質,均有可能引起不同程度的溶血
溶血應對策略:(1)血液離開人體后,血液環境的穩定性與保存時間的長短呈反比,細胞膜的穩定性也在下降,在這種情況下,應盡快開展血清血漿的分離;(2)不同的抗凝劑有其不同的分子構型,會對血液中各細胞的細胞膜產生不同的作用,有的會增加細胞膜的穩定性,有的會降低細胞膜的穩定性,所以選擇一款合適的抗凝劑至關重要(抗凝劑推薦:EDTA、檸檬酸鈉);(3)血液存放過程中溫度過高或反復凍融對細胞膜有很大的損害。溫度過高及反復凍融會使細胞膜上的結構蛋白構象發生改變,進而造成細胞膜的彈性降低以致破解產生溶血現象,所以用于分離血清血漿的血液應避免反復凍融
f. 細胞上清液、尿液、唾液、羊水、腦脊液(外泌體相似)
①收集細胞上清液、新鮮尿液、唾液、羊水、腦脊液(起始量按照前面表格中提示),要確保不能溶血(血液中蛋白會污染樣品蛋白);置于4°C 或冰盒中正立放置,轉移至RNase-free離心管。以下操作請在樣本收集后的1h內進行,以防RNA降解
②在4°C條件下離心3000g約10 min,去除細胞及碎片
③將上清小心傾倒入新的RNase-free離心管(注意不要轉移沉淀),在4°C條件下離心13000g約2 min,去除殘留的碎片及細胞
④轉移上清至全新的耐-192℃超低溫螺紋口凍存管中,?液氮速凍1h(可選),嚴密封口。-80°C保存,干冰運輸
注意事項:細胞上清液碎片過多,需要充分低速離心多次去除碎片。收集尿液的前一天飲食要清淡,晨起中段尿(臨床),晨間1h的尿液(動物)。唾液搜集之前需要禁食禁煙禁酒2h以上,上午9:30-11:30取樣,蒸餾水漱口,將唾液吐于無菌的痰杯(保持水浴),不要咳痰,采集唾液時間為30min左右,4℃ 10000rpm 10min,取上清,經0.22μm濾膜過濾除菌。
2.5 石蠟組織
手術/活檢組織石蠟塊

RNA單次提取需35mg以上的量。從醫院病理科切取手術組織總量≥35mg(綠豆大小,不可取暴露于空氣中的組織截面部分),活檢組織長度>1cm,需2-3條,蠟塊完整,無磕碰損傷的石蠟包埋組織。未切片的石蠟塊4℃或常溫運輸即可
手術/活檢組織石蠟卷片/活檢組織石蠟切片
RNA提取一次提取<80μm。從醫院病理科切取組織厚度約為10-20μm的石蠟卷片,手術組織10張(組織>1×1cm2),或20張(組織<1×1cm2),穿刺組織20-25張。將切好的卷片放置于耐-192℃超低溫螺紋口凍存管,迅速浸入液氮速凍>1h, -80℃保存或者干冰運輸。
注意事項:
a. 送樣優先順序:?石蠟塊>石蠟卷>石蠟切片
b. 所有石蠟組織樣本需盡量送檢一年以內的樣本,?不得超過18個月,建議提供一張免疫組化或組化染色切片
c. 新制切片常溫放置應在1周以內,2-8℃放置應在1個月以內,-20℃貯存應在6個月以內
d. 強烈建議每個貼片盒中只存放一個患者的樣本;若需與其他患者樣本放在一起,必須做間隔區分,防止樣本接觸造成污染

e. 強烈不建議使用添加瓦楞紙或自折Z形紙擺放石蠟切片,因運輸過程中的碰撞會導致石蠟切片擠到一起,造成切片破損或樣本污染。
石蠟組織容器

石蠟切片示例

2.6?非致病性細菌樣本采集
一次反應所需細菌的量≤1×107個
①顯微鏡下觀察生長狀態,收集對數生長期細菌;
②將適量體積的菌液轉移至2mL旋蓋尖底RNase-Free離心管中,室溫或4℃下14000g離心4-10min
③棄盡培養基,將細菌沉淀迅速置于?液氮速凍>1h,然后轉移至-80℃或液氮中長期保存,干冰運輸
2.7?非致病性真菌樣本采集
一次反應所需真菌的量≤50mg,將真菌稱重,分裝多管;將稱重后的真菌置于預冷的耐-192℃超低溫螺紋凍存管中,迅速投入液氮,速凍時間>1h,轉入-80°C長期保存或用干冰直接寄出。
2.8 致病性真菌細菌處理方法
所有可能致病的真菌、細菌RNA項目樣品,均需要按下面步驟預處理以后才能寄送至公司,且需要提前通知實驗室,明確菌種。溶液A,B可以向實驗室索要。實驗室將對未經處理的可能致病的樣品,進行銷毀處理
①細菌/真菌沉淀(不超過30mg,約綠豆大小)加入400ul溶液A,吹打重懸菌體。
②在重懸的菌體中加入400ul溶液B,劇烈震蕩混勻。
③65℃水浴或金屬浴加熱30min,每隔5min劇烈震蕩一次,防止分層。
④處理結束以后,-80℃凍存,干冰運輸。如為致病菌,請用70%乙醇處理容器表面(注意如處理過程中編號模糊,處理后重新寫好編號),確保安全。
注意事項:
(1)室溫較低時溶液A可能析出沉淀,可65℃預熱2-3min待沉淀溶解后混勻使用。
(2) 溶液B有腐蝕性,使用注意安全操作。溶液B為有機溶液,上層液體為水封,吸取時確保將槍頭插入下層液體。
(3) 溶液A,B不互溶,操作時需要震蕩充分,使兩種液體形成乳濁液。
(4) 樣品提交單上請注明:樣品經過溶液A,溶液B預處理。
2.9?Total RNA樣品
Total RNA一般長期保存于-80℃冰箱,若要寄送可直接使用干冰寄出,或加入適量保存液,再用干冰運輸。
RNA的保存介質(建議濃度>50ng/μL):
①RNA保存液(1/10體積3M NaAc,pH=5.2,3倍體積無水乙醇)
②3倍體積無水乙醇
③RNase-free水(送樣量>15μL)
注意事項:
(1) total RNA中應盡量避免多糖、蛋白、DNA等雜質的殘留,送樣時需注明溶劑成分
(2) total RNA應避免反復凍融,由于反復凍融所產生的剪切力會對RNA樣品有破壞作用,所以在實際操作中,應對RNA樣品小量分裝
輔助材料
1. 樣本包裝注意事項
①在包裹樣本的鋁箔或冷凍保存管表面,用油性記號筆標明樣本編號及樣本類型。并且不要與乙醇等有機溶劑接觸
②不要用紗布、紙張直接包裹樣本,而是用鋁箔或冷凍保存管包裹后再裝入樣本袋中
③不要用玻璃容器在液氮中保存樣本;
④不要把標簽紙或其他紙制的說明性文件放入樣本袋內,因為紙張在液氮中是易碎的
⑤標簽紙應該貼于樣本袋繩上,不要貼于容器表面以免脫落造成樣本混亂
⑥ 不要在一只樣本袋中放過多的樣本,以防無法放入液氮罐或無法從液氮罐中取出。樣本袋在使用前先在液氮中預冷
⑦ 客戶在填寫《樣本登記單》時應當詳細描述(臨床樣本則最好也注明臨床病因及所處階段)樣本的類型、處理方法、儲存條件以及儲存時間等相關細節,以便技術人員確定合理的實驗方案
3
樣本儲存注意事項
① 液氮速凍完畢后,攜帶樣本的凍存管或錫箔紙等應該立即放入-80℃保存。常規樣本在10min內必須立刻使用液氮速凍,不可直接將樣本在未經液氮速凍處理后直接放入-80℃保存。未經液氮淬滅的樣本中還會殘留低活性的酶,從而引起核酸降解以及蛋白變性
② 組織樣本采集后,樣本迅速放入進口高質量凍存管中,凍存管推薦使用進口的并且耐低溫-192℃的螺紋口凍存管,擰緊后立即放入液氮。然后再轉移到-80℃中保存。如果因為沒有擰緊會導致液氮流入凍存管,空氣熱脹冷縮后發生爆炸
③ 組織樣本儲存于液氮或-80℃冰箱中。對于液氮保存樣本,務必注意,不要用非螺口離心管和國產凍存管,因為這些管子從液氮中取出時極易發生管子爆裂而造成樣本損失。建議使用第②條提到的凍存管。實在條件缺乏必須使用封口膜將離心管充分封鎖防止爆炸(不推薦這樣操作)
4
樣本運輸注意事項
① 飛機運輸干冰上限約為20公斤,超過20公斤原則上不能運輸。火車運輸不受限制。
② 干冰運輸應采用壁厚且質量完好的泡沫箱,材料用編號后的凍存管存放,用塑料袋包裝后埋入干冰中,泡沫箱應扣嚴并用封箱帶封嚴。外套紙殼箱包裝,以免碰裂。并標明輕取輕放提示,以保證安全運輸
③ 干冰運輸可委托當地快遞公司,盡量確保48小時內送達公司,不能送貨上門的應提前通知公司相應人員。
④ 24小時到達的,干冰總量不得低于5公斤;48小時到達的,干冰總量不得低于8公斤。夏季可以適當再多增加部分干冰(平時的1.5倍)。不要使用大塊狀干冰或完全呈粉末狀的干冰,而是需要小的圓柱體干冰,否則運輸過程中自重比較大的塊狀干冰可能會在箱內擠壓樣品盒,移動中可能造成樣品盒破裂。如果只有大塊狀干冰可以使用,那么裝箱時先砸碎成小塊
⑤ 包裝時建議用大塑料袋包裹干冰并在箱中放冰袋,可有效減緩干冰揮發速度。選擇合適大小,且箱壁較厚的泡沫箱,并在泡沫箱外縱橫方向都纏上透明膠,最好是將泡沫箱外壁用膠帶覆蓋一遍,帶防止運輸途中因擠壓和拋擲而破裂。泡沫箱全部纏上膠帶后,為防止密封過緊,氣密性過強,干冰揮發產生過大壓力而造成泡沫箱爆裂,用美工刀或其他薄刃刀具,將纏在泡沫盒蓋和箱體接合處的膠帶刺破一個1-2厘米的小縫隙,以在氣壓過高時排出氣體
⑥ 如委托快遞運輸,運輸過程中應隨時跟蹤貨物的情況,記錄貨單號,并保持與發出地和接收地的快遞公司的聯系
5
注意事項
① 客戶如果提供凍存可復蘇的細胞株,應首先驗證所用凍存方法用于RNA提取的可靠性,并且在送樣時提供詳盡的復蘇方法,以便確保實驗成功
② 所有樣本均應標明準確的樣本編號,同時配有一張樣本登記表,寫明樣本名稱、物種、編號、取樣日期、樣本處理情況等。
③ 提取RNA質與量:a. 處于不同發育階段以及不同生長條件的樣本中所含有的RNA、RNA以及蛋白的量是不同的,在某些實驗條件下或某些病變部位獲得的樣本中核酸的量可能與常規相應樣本有顯著的差異;b. 儲存條件以及儲存時間也是影響RNA質與量的關鍵因素。一般來說從新鮮的樣本中總是能夠得到預期的核酸量,并且含量相對較高,更容易檢測。但是沒有保存在液氮或-80℃冰箱中的樣本是不可靠的,因此,強烈建議盡可能低溫保存。
④ 關于備份,為確保實驗的順利,我們強烈建議您在取樣時,應同時備份2-3份,如備份3份,則送給我們兩份,如果備份 2份,則送樣一份,您自己留一份,以防備部分樣本降解,重新取材或送樣耽誤您的時間。即使樣本全部合格,備份的樣本您還可以用來進行其他方面的實驗(如定量驗證,蛋白方面,生化方面的實驗等)。備份又分為兩種,一種為嚴格備份,即樣本取下后一分為二,這樣的兩份樣本基本上具備同性質。另一種為非嚴格備份,即生物學重復的樣本,這樣的備份樣本同質性要較前者差。
6
樣本寄送指南
① 將收集好的樣本置于相應的收集管中,為防止樣本混淆管蓋和管壁均要書寫編號,并用封口膜封口;
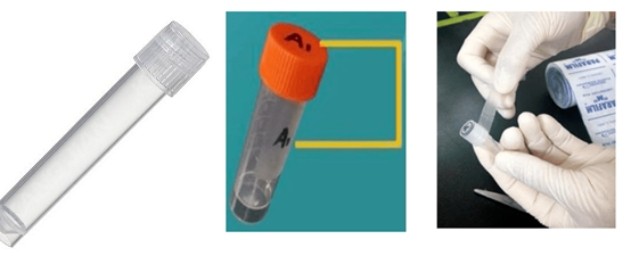

② 將樣本放入自封袋中,在樣本提交單上填好樣本詳細信息(編號等信息必須嚴格與樣本管上一致),將填好的樣本單和樣本一起放入泡沫箱中;
③ 選用大小合適、箱壁大于4 cm且密封性良好的泡沫箱,并在泡沫箱外縱橫方向都纏上透明膠,防止泡沫箱在運輸過程中的開裂。
④ 樣本寄送步驟:
?
在線咨詢
Online consultation
-
在線咨詢
-
技術支持

關注微信公眾號




